-------------------
-----------
باب في اليقين والتوكل تطريز رياض الصالحين /ج1.الكامل في اللغة/الجزء الأول /ج2.الكامل في اللغة/الجزء الثاني /ج3.الكامل في اللغة/الجزء الثالث /الكامل في اللغة/الجزء الرابع /الكامل في اللغة/الجزء الخامس /الكامل في اللغة/الجزء السادس /الكامل في /اللغة/الجزء السابع /الجزء 8. الكامل في اللغة /علل التثنية لابن جني /الفية ابن مالك /ابن هشام الأنصاري، من أئمة اللغة العربية /ج1.الكتاب (سيبويه)/المقدمة وج1 وج2. /تخريجات أحاديث الطلاق متنا وسندا مشمولة /فقه السنة تحقيق الشيالالباني /رياض الصالحين /فهرس رواة مسند الإمام أحمد /غاية المرام في تخريج أحاديث الحلال والحرام /المصطلحات الأربعة في القرآن /إغاثة اللهفان في مصائد الشيطان* /البرهان في رد البهتان والعدوان - أحاديث المزارعة/تصحيح حديث إفطار الصائم قبل سفره بعد الفجر /الحديث النبوي مصطلحه ، بلاغته ، كتبه /كتاب العلم للنسائي /قاموس الصناعات الشامية /تأسيس الأحكام /صيد الخاطر /صحيح الجامع الصغير وزيادته (الفتح الكبير) وضعيفه {... /صحيح سنن ابن ماجة {3--اجزاء} + ج4. ضعيف سنن ابن ماجهسنن أبي داود /{3 اجزاء الصحيح } و{الجزء4.ضعيفه} /صحيح الأدب المفرد.البخاري وج2.{وضعيفه} /صحيح الترغيب /والترهيب{ج1 و2 و3.} +ضعيفه /تحقيق إرواء الغليل للالباني8ج طبيعة 1. / /طلبعة 3.



 مقالة مفصلة: الهندسة الوراثية في نيوزيلندا
مقالة مفصلة: الهندسة الوراثية في نيوزيلندا  مقالة مفصلة: الهندسة الوراثية في الولايات المتحدة
مقالة مفصلة: الهندسة الوراثية في الولايات المتحدة 

 مقالة مفصلة: الجينات المستهدفة
مقالة مفصلة: الجينات المستهدفة 

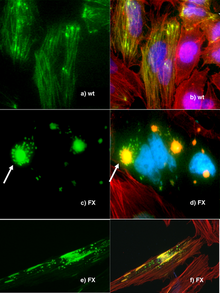

 طالع أيضًا: هندسة البشر الوراثية، وجدل حول الأغذية المعدلة وراثيا، وعضويات معدلة وراثيا
طالع أيضًا: هندسة البشر الوراثية، وجدل حول الأغذية المعدلة وراثيا، وعضويات معدلة وراثيا 
































































































































 -------------
-------------